PERSPECTIVA EVOLUTIVA
El síndrome de ovario poliquístico (SOP) es la causa más frecuente de
esterilidad
anovulatoria hiperandrogénica. Si bien se describió hace más de medio siglo, la
causa
subyacente aún no se conoce con certeza. Sin embargo, la información acumulativa
combinada con importantes progresos recientes, relacionados con las
alteraciones
neuroendocrinas y metabólicas y los reguladores autocrinos / paracrinos intra
ováricos
en el SOP, permitió una comprensión más cabal de la fisiopatología y las
consecuencias
en el largo plazo y posibilitó diversos enfoques para un manejo más eficaz de
estas pacientes.
Entre 1925 y 1935, Stein y Leventhal documentaron una asociación entre la
presencia
de ovarios poliquísticos y un cuadro de amenorrea, oligomenorrea, hirsutismo y
obesidad. Estas manifestaciones representaron en esa época los criterios
estrictos para
el diagnóstico de lo que se conoció con el nombre de síndrome de Stein –
Leventhal.
En 1964 Stein comunicó una normalización de los ciclos ováricos y la fertilidad
después
de la resección ovárica bilateral en cuña, en un porcentaje significativo de
pacientes en
quienes el diagnóstico se había establecido según los criterios mencionados
antes. ( 1 )
Estos resultados permitieron inferir la presencia de un defecto ovárico
primario y el
trastorno era en general designado con el nombre de enfermedad ovárica
poliquística.
Estudios clínicos, morfológicos, bioquímicos y endocrinológicos ulteriores
revelaron un
espectro de alteraciones subyacentes. Estos hallazgos condujeron al término
síndrome
del ovario poliquístico, para describir la heterogeneidad de este trastorno.
Durante los veinte años siguientes, en pacientes con SOP se describieron
alteraciones
funcionales interrelacionadas en todos los niveles del eje hipotálamo –
hipófisis –
ovarios; también se determinó la hiperfunción del eje hormona luteinizante –
células
tecales, con producción excesiva de andrógenos, y la hipofunción del eje
hormona
folículo estimulante – células granulosas, causante de una producción acíclica
de
estrógenos y de ciclos anovulatorios crónicos resultantes ( 2-5 ). Junto con la
formación
extraglandular de estrógenos y sus efectos sobre la función del eje hipotálamo
–
hipófisis – ovarios, se demostró la presencia de un círculo vicioso en los mecanismos
fisiopatológicos del SOP ( 6,7 ).
Más importante aun, en las mujeres con SOP se descubrió una forma singular de
resistencia a la insulina, asociada con hiperinsulinemia, (8-10) que podría
contribuir a
interrelacionar las alteraciones observadas en el eje hipotálamo –
hipófisis-ovarios y
fuera de él. Esta interrelación abarcaría la capacidad de la insulina de actuar
en forma
sinérgica con el efecto trófico de la LH sobre las células tecales, para
aumentar la
producción de andrógenos, y de inhibir la producción hepática de proteína
fijadora del
factor de crecimiento símil-insulina (IGF) 1 (IGFBP-1) y globulina fijadora de
hormonas sexuales (SHBG). Estas son proteínas fijadoras de alta afinidad que,
respectivamente, regulan la biodisponibilidad de IGF y esteroides sexuales para
las
células efectoras. (11,12)
La demostración de alteraciones de la lipólisis, secundarias a una disminución
de la
densidad de receptores beta2-adrenérgicos en los adipocitos abdominales de
mujeres no
obesas con SOP (un hallazgo que favorece el desarrollo de obesidad), es una de
las
claves para comprender la patogenia de la resistencia a la insulina en este
síndrome.
(13) En la actualidad se incluyó la insulina y la hormona del crecimiento (GH)
como
presuntas cogonadotrofinas, que actuarían en forma sinérgica con la LH para
estimular
un aumento de la producción ovárica de andrógenos; el efecto relativo de cada
una de
estas hormonas depende de la cantidad de adipocitos. (14-16) Avances paralelos
en la
comprensión de las señales neuroendocrinas – metabólicas, que gobiernan los
mecanismos de maduración durante la adrenarca y la pubertad, incluida la
resistencia
insulínica fisiológica, y la identificación de semejanzas endocrinometabólicas
entre el
hiperandrogenismo de la adolescencia y el SOP, en mujeres adultas, confirmaron
la
instalación peripuberal de este síndrome. (17-22) Además, las evidencias
disponibles
hasta el presente avalan la hipótesis de que una adrenarca exagerada contribuye
al
hiperandrogenismo adrenal, la hipersecreción de LH y al hiperandrogenismo
ovárico
durante la pubertad. (23-25)
DEFINICIÓN
La definición clínica de síndrome de ovario poliquístico más ampliamente
aceptada es
la asociación de hiperandrogenismoconanovulación crónica en mujeres sin
enfermedades subyacentes específicas de las glándulas adrenal o pituitaria.
(26)
PREVALENCIA
Parece que el síndrome de ovario poliquístico es la causa de infertilidad
oligo-ovulatoria
en muchas mujeres. (27) es uno de los desórdenes endocrinológicos reproductivos
más
comunes en las mujeres. En un estudio reciente de caso 400 mujeres en edad
reproductiva en Alabama, divididas aproximadamente de manera igual entre
mujeres
blancas y negras, se reportó que aproximadamente el 4% sufrió de SOP, sin tener
en
cuenta la raza.(28) Otros investigadores que estudiaron otras poblaciones han
confirmado que el 4 al 6% de las mujeres en edad reproductiva en la población
general
sufren de SOP. (29,30)
DIAGNOSTICO
Muchos médicos podrían estar de acuerdo que el síndrome de ovario poliquístico
(SOP )
puede ser diagnosticado clínicamente en la mujer que se presenta con
hirsutismo, ciclos
menstruales irregulares, obesidad y una clásica morfología ovárica; sin embargo
controversias considerables permanecen respecto a los criterios diagnósticos
para SOP
en mujeres quienes se presentan con pocos de los síntomas clásicos. (31)
Después de un debate considerable en el año 1990 en una conferencia sobre SOP
en el
instituto nacional de salud, tres criterios mínimos fueron propuestos (26)
1. Irregularidad menstrual
2. Evidencia de hiperandrogenismo, ya sea, clínica (hirsutismo, acne, o patrón
de
calvicie masculino) o bioquímica ( niveles de andrógenos elevados en suero).
3. Exclusión de otras enfermedades
Así el diagnóstico de SOP no requiere una prueba bioquímica anormal o
ultrasonido
pélvico para evaluar la morfología ovárica; sin embargo, esto requiere la
medición de
TSH, prolactina y probablemente FSH, testosterona total, S-DHA, 17 OH
progesterona
para excluir mujeres con otras causas conocidas de hiperandrogenismo femenino.
Tales
como hiperplasia adrenal congénita, tumores secretores de andrógenos e
hiperprolactinemia. Debido a que la morfología clásica de ovario poliquístico
es
descrita en 20-25% de mujeres con ovulación regular normal (32) la presencia de
esta
morfología sola es insuficiente para hacer el diagnóstico de SOP en mujeres
quienes
tienen ciclo menstrual ovulatorio regular o quienes no tienen hiperandrogenismo
(31)
DIAGNÓSTICO DIFERENCIAL
El diagnóstico diferencial de SOP incluye otras causas de exceso androgénico.
Los componentes de la historia y examen físico son necesarios para diagnosticar
la
causa subyacente de la oligoovulación. La historia debería enfocarse en el
inicio y
duración de varios signos de exceso androgénico, la historia menstrual, y los
medicamentes concomitantes, incluyendo el uso de andrógenos exógenos. Una
historia
familiar de diabetes y enfermedad cardiovascular (especialmente familiares de
primer
grado con inicio prematuro de enfermedad cardiovascular [hombres menores de 55
años
y mujeres menores de 65 años]) es importante. Los factores del estilo de vida,
tales
como fumar, el consumo de alcohol, la dieta, y el ejercicio, son
particularmente
importantes en estas mujeres. (33)
FACTORES A CONSIDERAR EN EL DIAGNÓSTICO DIFERENCIAL DE EL
SÍNDROME DE OVARIO POLIQUÍSTICO
Tumor de secreción androgénica
Andrógenos exógenos
Síndrome de Cushing
Hiperplasia adrenal congénita no clásica
Acromegalia
Defectos genéticos en la acción de la insulina
Amenorrea hipotalámica primaria
Falla ovárica primaria
Enfermedad tiroidea
Desórdenes de prolactina
El examen físico debería incluir una evaluación de calvicie, de acné,
clitoromegalia, y
distribución del vello corporal, también como un examen pélvico para buscar
aumento
del ovario. La presencia y severidad del acné debería notarse. Los signos de
resistencia
a la insulina, tales como obesidad, la distribución grasa centrípeta, y la
presencia de
acantosis nigricans, se debe registrar. La acantosis nigricans es una condición
dermatológica marcada por piel hiperpigmentada, verrugosa, aterciopelada y
musgosa.
Esto se ha notado en la parte posterior del cuello, en las axilas, debajo de
los senos, y
aún en la vulva. La presencia de acantosis nigricans parece ser más un signo de
resistencia a la insulina que una enfermedad distinta por si misma. Otras
condiciones
patológicas asociadas con acantosis nigricans se debe considerar, tales como
insulinoma
y enfermedad maligna, especialmente adeno carcinoma del estómago. (33)
Debido a que el síndrome de Cushing es extremadamente raro (1 en 1000000) y los
test
de screening no son 100% sensibles o específicas (34), el screening de rutina
para síndrome de Cushing en todas las mujeres con anovulación crónica
hiperandrogénica no está indicada. Aquellas quienes tienen signos coexistentes
del síndrome de Cushing, incluyendo unas facies de luna, joroba de búfalo,
estrías abdominales, distribución grasa centrípeta o hipertensión, debería ser
evaluado.
Los tumores de secreción androgénica del ovario o la glándula adrenal son
invariablemente acompañados por niveles de andrógenos en circulación elevados.
Sin
embargo, no existe nivel absoluto que sea patognomónico para un tumor, ni
tampoco
existe nivel androgénico mínimo que excluya un tumor. En el pasado, los niveles
de
testosterona mayores de 2ng/mL y de dehidroepiandrosterona sulfato mayores de
700ug/dL fueron catalogados como sospechosos de etiología de tumor de ovario y
adrenal, respectivamente. Pero estos niveles de corte tienen pobre sensibilidad
y
especificidad.(35)
La mejor medida de andrógenos circulantes para documentar excesos de andrógeno
no
explicados es incierto. La evaluación de testosterona o de testosterona
biodisponible es
útil para documentar el hiperandrogenismo ovárico. La evaluación de
dehidroepiandrosterona puede ser útil en casos de rápida virilización (como un
marcador de origen adrenal), pero su utilidad en la evaluación de hirsutismo
común es
cuestionable.(33)
Las glándulas adrenales y los ovarios contribuyen al pool de andrógenos circulantes
en
las mujeres. La glándula adrenal preferencialmente secreta andrógenos débiles,
tales
como DHEA o DHEAS (hasta el 90% de origen adrenal). Estas hormonas, además de
la androstenediona, puede servir como prohormonas para la mayoría de andrógenos
potentes, tales como la testosterona o la dihidrotestosterona. El ovario es la
fuente preferencial de testosterona, y se estima que el 75% de la testosterona
circulante se origina de el ovario ( principalmente a través de la conversión
periférica de prohormonas por el hígado, la grasa, y la piel, pero también a
través de la secreción directa). La androstenediona, principalmente de origen
ovárico, es el único andrógeno circulante que está más alto en las mujeres
premenopáusicas que en los hombres, aun su potencia androgénica es solo el 10%
de testosterona. La dihidrotestosterona es el andrógeno más potente, aunque
circula en cantidades negligentes y resulta principalmente de la 5 alfa
reductasa intracelular.
Las elevaciones moderadas de prolactina son comunes en mujeres con SOP (36) Un
nivel de prolactina puede identificar prolactinomas que secretan grandes
cantidades de
prolactina y que puede estimular la producción de andrógenos ováricos, pero
esto es una
causa extremadamente rara de anovulación hiperandrogénica crónica. Los niveles
séricos en evaluación de la hormona estimulante de la tiroides también es útil
en dar las
manifestaciones de protección y la frecuencia de enfermedad tiroidea en
mujeres. (33)
RESISTENCIA A LA INSULINA O SÍNDROME METABÓLICO
El término resistencia a la insulina no debería confundirse con el concepto de
la
resistencia insulínica o síndrome metabólico. Este concepto fue primero
introducido
por Reaven (37) como síndrome X en los años 80s para describir una agrupación
de
factores de riesgo cardiovascular incluyendo hipertensión, obesidad, y
dislipidemia
(aumento de triglicéridos y disminución de lipoproteínas de alta densidad) que
están frecuentemente asociadas con resistencia insulínica. Este síndrome se ha
referenciado debido a una variedad de nombres incluyendo síndrome X, síndrome
de Reaven, cuarteto de la muerte, síndrome metabólico cardiovascular, síndrome
de resistencia insulínica, síndrome dismetabólico y el síndrome metabólico.
En 1999, la WHO propuso una definición unificada para el síndrome y elige
llamarlo
síndrome metabólico (38,39). La definición del trabajo de síndrome metabólico
propuesto por la WHO fundamentó que estas pacientes tuvieron alta intolerancia
a la
glucosa o diabetes mellitus tipo 2 y / o resistencia insulínica, junto con dos
o más de las
siguientes características:
Presión arterial aumentada (>140/90 mmHg).
Triglicéridos plasmáticos aumentados (>150 mg/dL) y / o bajo HDL –
colesterol
(<35mg/dL en hombres; <39mg/dL en mujeres).
Obesidad central (hombres: radio de cintura a cadera de >0.9;mujeres radio
de cintura a
cadera >0.85) y/o IMC de >30kg/m2 .
Microalbuminuria (tasa de excreción de albúmina urinaria de >20ug/ min o
proporción
albúmina-creatinina de >30mg/g).
Aunque varios componentes de el síndrome metabólico se han descrito ( por
ejemplo
hiperuricemia, niveles elevados de inhibidor – 1 activador de plsminógeno),
ellos no
son considerados parte de los criterios diagnósticos propuestos. La aplicación
de la definición propuesta a una población de individuos de Finlandia y Suiza
(estudio de
Botnia), aproximadamente el 10% de personas con tolerancia normal a la glucosa
(NGT), el 40% de personas con intolerancia a la glucosa (IGT), y el 85% de las
pacientes con diabetes mellitus tipo 2 tendrían síndrome metabólico. Sin
embargo, la
prevalencia es muy dependiente de la edad y es generalmente mayor en hombres
que en
mujeres (40,41)
En EEUU, los datos de la tercera fuente de salud nacional y de examen
nutricional
(NHANES III) ha usado la definición de trabajo proveída por el tercer reporte
del panel
de expertos en el programa de educación nacional del colesterol en la
detección,
evaluación y tratamiento del alto colesterol sanguíneo en adultos (ATP III)
para estimar
la prevalencia del síndrome en 8.814 hombres y mujeres con edad >20 años.
(42,43). El
ATP III definió el síndrome metabólico como presente cuando 3 de las siguientes
anormalidades están presentes:
circunferencia de cintura de >102 cm en hombres y 88cm en mujeres.
nivel de triglicéridos séricos de >150mg/dL (1.69 mmol/L); nivel de
colesterol y
lipoproteína de alta densidad de <40mg/dL (1.04 mmol/L) en hombres y 50
mg/dL
(1.29mmol/L) en mujeres.
presión sanguínea de >130/85 mmHg.
un nivel de glucosa sérica de >110mg/dL (6.1mmol/L) (43)
PRESENTACIÓN CLINICA Y PARACLINICOS
Disfunción menstrual: uno de los sellos característicos del SOP es el sangrado
uterino
irregular e impredecible. Comúnmente, los episodios de sangrado son
infrecuentes,
ocurren menos de 6 veces por año, aunque en algunos pacientes, el sangrado
puede ser
observado mensualmente. El grado del sangrado puede variar considerablemente.
Debido a que la producción de estrógenos en el SOP es constante y no opuesto
por progesterona, una proliferación endometrial puede ser substancial y llevar
a hiperplasia
endometrial. Si el grosor del endometrio no puede ser sostenido por la
secreción de estrógenos, el desprendimiento de la capa superficial puede
ocurrir con leve sangrado o
spotting. Alternativamente, una declinación súbita en los niveles circulantes
de
estrógenos puede ser asociado con una substancial cantidad de sangrado que,
raramente,
puede requerir una intervención clínica inmediata.(44)
La ocurrencia de oligomenorrea puede ser explicada por el SOP en
aproximadamente 85
a 90% de las mujeres, mientras un 30 a 40% de pacientes amenorreicas han sido
reportadas a tener este desorden ( 45).
Exceso de Andrógenos: la expresión clínica más distintiva del SOP es el
excesivo
crecimiento del vello, lo cual ocurre en aproximadamente 80% de los pacientes (
46 ).
El rostro y la barbilla están comúnmente involucradas, otras áreas comúnmente
afectadas incluyen en pecho y el periné. En casos severos, la espalda y las
extremidades
pueden mostrar excesivo vello.
Infertilidad: un número significante de pacientes tienen infertilidad como una
presentación característica del SOP ( 46). La anovulación es considerada a ser
el
defecto primario responsable para la falla en alcanzar el embarazo en este
desorden; sin
embargo, otras consideraciones potenciales pueden existir. La evidencia sugiere
que
mujeres con SOP tienen una alta incidencia aborto espontáneo , mecanismo que
permanece incierto. ( 47).
Resistencia a la insulina: las mujeres adultas con SOP exhiben resistencia a la
insulina e
hiperinsulinemia. ( 48,49,50). Esto es particularmente cierto en individuos
obesos en
quienes la Diabetes Mellitus no insulinodependiente parece ser más prevalente
en
comparación con pacientes con SOP no obesas (51,52). En el SOP, los disturbios
del
metabolismo de la glucosa y la secreción de insulina no son obvios hasta tarde
en la
vida. 20 a 40% de pacientes obesas con SOP tienen intolerancia a la glucosa o
Diabetes
Mellitus tipo 2 por el fin de su cuarta década (52). El incremento en la
secreción de
insulina ha sido asociado a la aparición de acanthosis nigricans en pacientes
obesas con
SOP; sin embargo, la correlación de severidad entre estos dos factores no ha
sido
consistentemente observado.
Obesidad: no todas las mujeres con SOP exhiben obesidad. Aproximadamente el 50%
de las pacientes han sido encontradas a ser obesas ( 53). Estudios han sido
realizados en
los cuales el inicio de obesidad ha sido relacionado con la aparición de
disfunción
menstrual en SOP. La distribución de la adiposidad puede también ser una
consideración. Los pacientes tienden a tener un aumento en la proporción
cintura a cadera o un patrón androide de obesidad ( 54)
PARACLINICOS
Básicamente, el diagnóstico de laboratorio del SOP es de exclusión.
Tradicionalmente,
ha sido recomendado que pacientes en quienes se sospeche un SOP sufran una
evaluación endocrina mínima consistente en mediciones en suero de testosterona
total,
SDHEA, y cuando este indicado, 17-hidroxiprogesterona. La razón primaria para
obtener medidas de testosterona y SDHEA es para excluír la posibilidad de un
tumor
productor de andrógenos del ovario o glándula adrenal, respectivamente. La
determinación de 17-hidroxiprogesterona es util para la detección de una
hiperplasia
suprarrenal congénita por la deficiencia de 21-hidroxilasa . Como parte de la
evaluación de oligomenorrea debido a anovulación, la medición de prolactina y
TSH
debe ser tenida en cuenta en algunas instancias. En SOP, la elevación de
prolactina en
el suero ha sido reportada a ser tan alta como 35% y probablemente relacionada
a la
estimulación lactotrópica por exposición estrogénica crónica.
Los desordenes de secreción tiroidea han sido asociados con sangrado menstrual
irregular. Usualmente, existen otras características clínicas acompañantes que
sugieren
el diagnóstico.
Existe una amplia práctica de mediciones en suero de LH y FSH, pero la
determinación
de los niveles circulantes de estas glicoproteínas no contribuyen
significativamente al
diagnóstico de SOP ( 44 ). Intensos estudios de secreción de gonadotropinas han
documentado claramente la rápida frecuencia de pulsos de LH en el SOP comparado
con mujeres normales ( 55,56 ); sin embargo, incrementos de secreción de LH
hipofisiaria no siempre pueden ser determinados por mediciones de la
concentración
sérica debido a que aproximadamente un tercio de los pacientes tienen niveles
circulantes de LH en el rango normal. Lo mismo es cierto en la proporción de LH
a
FSH, lo cual no proporciona utilidad adicional.
La observación que mujeres con SOP son insulinoresistentes y tienen hiperinsulinemia
compensatoria aumenta el interrogante de si una evaluación del metabolismo de
glucosa
y secreción de insulina debería ser realizado. En muchos pacientes, la
alteración de
tolerancia a la glucosa puede ser demostrada. Así, las consecuencias de salud a
largo
plazo del SOP que son relacionadas a la resistencia a la insulina e
hiperinsulinemia
deberían ser incluídas entre aquellas asociadas con producción anormal de
esteroides.
Recientemente, ha sido mostrado que la proporción de glucosa en ayunas a
niveles de
insulina proporciona una alta sensibilidad y especificidad en la detección de
pacientes
con resistencia a la insulina (57). Debido a los riesgos de la salud a largo
plazo, la
secreción de insulina debe ser evaluada una vez el diagnóstico de SOP ha sido
establecido.
FISIOPATOLOGÍA
El SOP se manifiesta clínicamente por una combinación de hiperandrogenismo con
anovulación crónica y un aumento de la relación LH: FSH. El hiperandrogenismo
se
traduce en hirsutismo, acné y en casos raros, en una alopecia dependiente de
los
andrógenos asociados con un aumento de los niveles séricos de testosterona y
androstenodiona. La anovulación crónica se asocia con oligomenorrea o
amenorrea, y
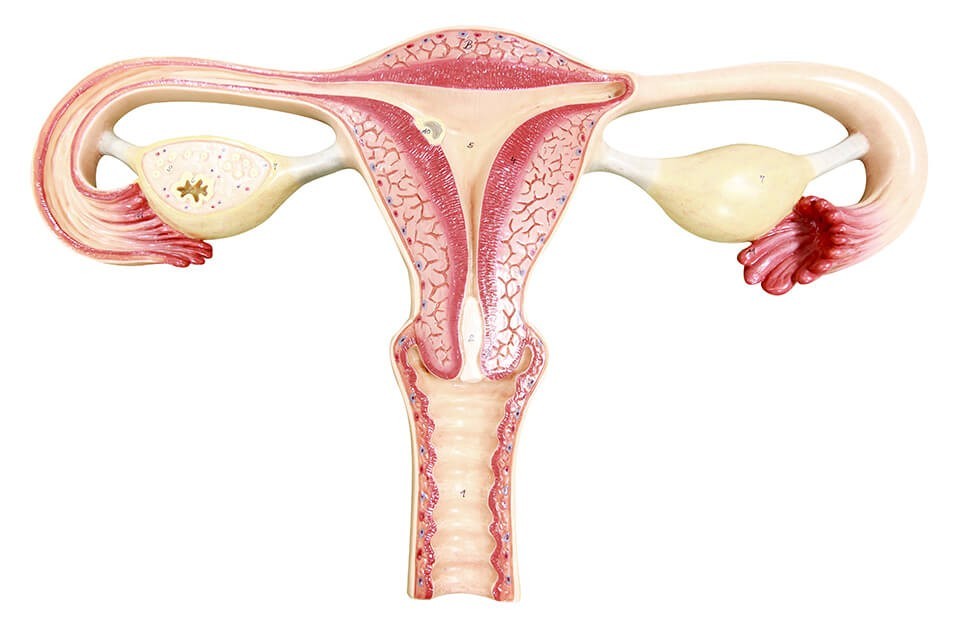
con la presencia de ovarios poliquísticos bilaterales en la ecografía. La
obesidad es un
hallazgo frecuente pero no es una condición sinequanon para el desarrollo de
SOP, dado
que un 50% de las mujeres con este síndrome no son obesas. La obesidad es una
entidad nosológica en sí cuya asociación con resistencia a la insulina / hiperinsulinemia
y alteraciones de la secreción de GH ha sido claramente establecida. Por lo
tanto, la
presencia de una disfunción neuroendocrino metabólica en ausencia del factor
agregado
obesidad, en mujeres con SOP, puede considerarse como el proceso fisiopatológico
subyacente a un síndrome auténtico del que la obesidad sería un modificador.
Este axioma fundamental podría facilitar la evaluación de las pacientes y la
interpretación de las manifestaciones clínicas, los resultados de laboratorio y
las secuelas en el largo plazo de mujeres con SOP. (58)
SECRECIÓN INAPROPIADA DE GONADOTROFINAS
En 1970 se hizo un estudio en mujeres en las cuales se encontró una secreción
de LH
desproporcionadamente elevada, con un nivel reducido y relativamente constante
de
FSH. (2)
ACELERACIÓN DE LA ACTIVIDAD PULSÁTIL DE GnRH/LH
En las mujeres con SOP se documentó en forma fehaciente un aumento de la
frecuencia
del pulso de LH con independencia del índice de masa corporal (IMC) o del grado
de
adiposidad. (59,60). Si bien en mujeres no obesas con SOP puede apreciarse con
claridad hipersecreción de LH, mayor relación LH:FSH y un aumento de la
intensidad
de la respuesta de LH a la hormona liberadora de gonadotrofinas (GnRH), la
presencia
de obesidad atenúa estas alteraciones neuroendocrinas, (60,56). En un estudio
de
mujeres con SOP y un peso corporal normal se observó un aumento de la amplitud
del
pulso de LH , junto con una aceleración de la frecuencia del pulso de LH que
determinó
un nivel mediode LHen 24 horas tres veces mayor que el normal.(60). Por el
contrario,
en mujeres obesas con SOP la amplitud del pulso de LH y la respuesta de éste a
la
GnRH disminuyeron en relación directamente proporcional al grado de adiposidad;
la
duplicación del nivel medio de LH en 24 horas se debió exclusivamente al
aumento de
la frecuencia del pulso de LH (60). Así, el aumento de la frecuencia del pulso
de LH es
una característica específica del SOP independiente de la obesidad. La
presencia de
obesidad en mujeres con SOP actúa como un modificador, que ejerce un efecto
negativo
sobre la amplitud del pulso de LH pero no sobre la frecuencia del pulso. El
hecho de
que ya sea posible identificar un aumento de la frecuencia y la amplitud del
pulso de LH
en niñas prepúberes con hiperandrogenismo ovárico (21,22) sustenta la hipótesis
de que
la aceleración del generador del pulso de GnRH representaría un defecto
intrínseco del
SOP y una evidencia más de su instalación prepuberal. (5).
DISCREPANCIAS ENTRE LA SECRECIÓN DE LH Y LA SECRECIÓN DE FSH
El nivel desproporcionadamente reducido y constante de FSH observado en mujeres
con
SOP podría representar la alteración crucial responsable de la interrupción
folicular
asociada con este síndrome. En comparación con la fase folicular temprana, en
las
mujeres con SOP el nivel de FSH se encuentra reducido en alrededor de un 30%.
(2)
Dado que para iniciar la foliculogénesis es necesario un aumento del nivel de
FSH del
orden del 30% con respecto al nivel de la fase lútea, (61) la persistencia de
un nivel
inalterado de FSH en el SOP podría ser el factor determinante de la
interrupción del
desarrollo folicular.
Esta persistencia puede revertirse con facilidad mediante la administración de
una dosis
reducida de FSH exógeno. (62,63) Las evidencias disponibles sugieren que los
niveles
relativamente fijos de FSH también estarían relacionados con la alta frecuencia
de los
pulsos de GnRH. En este contexto, los genes de las subunidades de
gonadotrofinas son
regulados en forma diferencial por la GnRH. Este regula en más el receptor de
GnRH,
lo que determina un aumento de la señal GnRH. Los pulso GnRH de alta frecuencia
inducen un aumento selectivo del ácido ribonucleico mensajero (mRNA) para LH
–beta
sin afectar al mRNA para FSH-beta, de lo que resulta una mayor secreción de LH
que
de FSH. A la inversa, una disminución de la frecuencia de los pulsos de GnRH
determina un aumento selectivo del mRNA para FSH-beta, lo que a su vez conduce
a
una mayor secreción de FSH que de LH. Además, la frecuencia elevada de los
pulsos
de GnRH induce un aumento de la proteína intrahipofisaria con alta afinidad
para la
fijación de activina, conocida como Folistatina, lo que disminuye la actividad
liberadora
de FSH de la activina (64,65). Por lo tanto, la discrepancia entre la secreción
de LH y
FSH en el SOP es consecuencia de la aceleración de la frecuencia del pulso de
GnRH.
NIVELES DE LH COMO INDICADORES
En los casos en los que se utilizan los niveles basales de LH como indicadores
clínicos
de SOP, un porcentaje significativo de pacientes no presentan una elevación del
nivel de
LH y ,en consecuencia, tampoco de la relación LH: FSH. Esta observación
determinó
que en 1990 se llevase a cabo una conferencia para establecer acuerdos acerca
de los
criterios diagnósticos de SOP, la que fue auspiciada por el National Institute
of Child
Health and Human Development. Se llegó a la conclusión de que el diagnóstico de
SOP no requiere un aumento del nivel de LH y de la relación LH: FSH. (26) En
varios
estudios se observó que en las mujeres con SOP la obesidad ejerce un efecto
negativo
sobre los valores basales de LH. (66) Este tópico fue evaluado en fecha
reciente a lo
largo de un amplio espectro de valores de IMC mediante técnicas más sensibles
que
demostraron que la obesidad ejerce un efecto negativo sobre la amplitud del
pulso de
LH en el nivel hipofisiario, sin afectar la frecuencia del pulso de FSH. En
consecuencia, en estos casos también disminuye la relación LH: FSH. (56) Si se
considera el grado de adiposidad, las pacientes con SOP y un IMC DE 30kg/m2 o
menos presentan niveles medios de LH en 24 horas significativamente más
elevados
que los controles normales con un grado de adiposidad similar, mientras que
entre las
mujeres obesas con un IMC mayor de 30kg/m2 los niveles de LH no permitieron
diferenciar pacientes con SOP en mujeres normales, en alrededor de un 50% de
los casos.
Un hallazgo clínicamente importante es que la media de dos niveles de LH
determinados en muestras recolectadas cada 30 minutos (pero no en una muestra
aislada) se asoció con un poder discriminatorio similar al del valor medio de
LH en 24
horas. la influencia negativa de la adiposidad sobre la amplitud (pero no sobre
la
frecuencia) del pulso de LH podría explicar la heterogeneidad de los valores de
esta
hormona observado en mujeres con SOP dentro de un amplio espectro de IMC o
grado
de adiposidad. En consecuencia, se sugirió que la evaluación de los niveles de
LH y la
relación LH: FSH en dos muestras separadas por un período de 30 minutos tiene
valor
diagnóstico cuando se tienen en cuenta el IMC y el grado de adiposidad.
EJE LH – CÉLULAS TECALES
En el síndrome de ovario poliquístico la estimulación crónica de la LH induce
una
hipersecreción persistente de andrógenos por parte de las células tecales. La
hiperactividad de estas células se manifiesta in-vivo por la hiperreactividad
de la 17-
hidroxiprogesterona a la administración de agonista de la GnRH (67) y a la
estimulación
con gonadotrofina coriónica humana . La evaluación de la capacidad
esteroidógena de
las células tecales en mujeres con SOP reveló que las respuestas de la 17 –
hidroxiprogesterona y la androstenodiona a la administración de una dosis
fisiológica de
LH fueron 8 y 20 veces mayores, respectivamente, en las células tecales de
mujeres con
SOP en comparación con lo observado en mujeres con ovarios normales (68).
Además,
la respuesta de la 17 – hidroxiprogesterona a la estimulación de la HCG,
después de la
supresión de la LH endógena mediante un agonista de la GnRH durante 6 semanas,
también fue significativamente mayor en pacientes con SOP que en mujeres
normales Por lo tanto, los datos recolectados in vitro son compatibles con los
resultados obtenidos in-vivo y avalan la hipótesis de la “desregulación de la
enzima P450 c17 ovárica” en la vía esteroidógena de las células tecales en
mujeres con SOP (67).
EJE FSH – CÉLULAS GRANULOSAS
Los quistes foliculares presentes en los ovarios de pacientes con SOP no
alcanzan una
maduración completa; esta ausencia de folículos maduros determina una baja
producción de estradiol. En estos folículos de maduración detenida las células
granulosas son escasas y están virtualmente desprovistas de actividad de la
P450
aromatasa. Sin embargo, el examen de las células granulosas in vitro revela que
no son
apoptósicas, expresan niveles elevados de receptores FSH y son altamente
reactivas a la
FSH in vitro e in vivo (63). En consecuencia, la integridad funcional de las
células
granulosas de los ovarios poliquísticos se encuentra completamente preservada,
junto
con el mecanismo de señalización FSH que estimula la aromatización de la
androstenodiona y la formación resultante de estradiol. Por lo tanto, la escasa
actividad
aromatasa en mujeres con SOP implica la existencia de una FSH inadecuada o de
un
bloqueo de sus efectos in- vivo. Dado que el líquido folicular obtenido de
pacientes con
SOP contiene concentraciones saturadas de IGF- 1 y FSH, se sugirió la presencia
de
inhibidores de la FSH y el IGF – 1. Si bien este tópico se está investigando
con
intensidad, las evidencias disponibles sugieren una disminución de la
biodisponibilidad
de IGF debida al efecto inhibidor del aumento del nivel folicular de IGFBP que
determina la interrupción del desarrollo folicular en el SOP .
RESISTENCIA A LA INSULINA EN EL SOP
El SOP se asocia con resistencia periférica a la insulina e hiperinsulinemia,
la gravedad
de ambos trastornos aumenta en presencia de obesidad (60). estudios de la
disposición
de la glucosa mediada por insulina demostraron que las mujeres con SOP
presentan una
resistencia a la insulina periférica de magnitud similar a la observada en
pacientes con
diabetes mellitus no insulinodependientes (10). La hiperinsulinemia resultante
es un
mecanismo destinado a contrarrestar la alteración del consumo de glucosa
mediado por
la insulina en mujeres con SOP. La obesidad, a menudo asociada con el SOP (50%
de
los casos), ejerce un efecto negativo adicional sobre la resistencia a la
insulina, como lo
indica una mayor disminución de la sensibilidad a la insulina hepática en
comparación
con la asociada con la obesidad exclusivamente en mujeres obesas con SOP. (60).
Se
documentó una correlación positiva entre el grado de hiperinsulinemia y el
hiperandrogenismo. La reducción de la secreción ovárica de andrógenos no
modifica la
resistencia a la insulina, pero la reducción de la hiperinsulinemia se asocia
con una
reducción significativa del nivel sérico de testosterona (69). La intolerancia
a la glucosa
se puede observar en mujeres obesas con SOP, pero es un hallazgo raro en no
obesas
afectadas por el síndrome. La presencia de disfunción de las células beta,
expresada por
una disminución de la secreción de insulina de primera fase en respuesta a la
estimulación con glucosa, es un hallazgo más frecuente en mujeres con SOP (60).
Por lo
tanto, estas pacientes presentan resistencia a la insulina y disfunción de las
células beta.
El mecanismo celular responsable de la resistencia a la insulina en el SOP fue
investigado en el adipocito, una clásica célula efectora de la insulina. Se
observó que la
cantidad de receptores para la insulina y la afinidad de los receptores eran
normales.
Por el contrario, en los adipocitos de pacientes con SOP se observó una
desviación pronunciada de la curva dosis – respuesta del consumo de glucosa
mediado por la insulina hacia la derecha, la cual fue independiente de la
presencia o ausencia de obesidad. (70). Esta alteración del consumo de glucosa
se acompaña con una disminución de la cantidad de transportadores de glucosa en
los adipocitos (71).
También se documentó una disminución de la autofosforilación de los receptores
para
insulina en esas células. Además, en los adipocitos de pacientes con SOP la
sensibilidad a los efectos antilipolíticos de la insulina es 3 veces menor.
Considerados
en conjunto, estos hallazgos sugieren que la resistencia a la insulina del SOP
se asocia
con defectos del transporte de glucosa y la antilipólisis , y que estas
alteraciones tienen
lugar en un estadío temprano de la vía de señal insulínica común para la
estimulación
del transporte de glucosa y la antilipólisis.
OBESIDAD
Alrededor del 50% de las mujeres con SOP son obesas; este porcentaje es
significativamente mayor que la incidencia de obesidad en la población general
( 30%).
Cuando la ingestión de energía excede el gasto en forma crónica, la mayor parte
del
exceso se almacena en el tejido adiposo en la forma de triglicéridos. La
insulina y los
glucocorticoides promueven la lipogénesis, mientras que la lipólisis es
regulada por la
estimulación beta-adrenérgica y por reducciones de las propiedades lipógenas de
la
insulina y los glucocorticoides.
LIPOGÉNESIS. RECEPTOR HORMONAL NUCLEAR PPARy
El descubrimiento del PPARy , un miembro de la subfamilia de receptores
hormonales
nucleares activados por peroxisoma proliferador (PPAR), contribuyó
significativamente
a la comprensión de la biología de las células adiposas. PPARy se encuentra
presente
principalmente en el tejido adiposo y actuaría como factor de transcripción y
regulador
clave de la adipogénesis. La actividad adipógena de PPARy es significativamente
aumentada por la presencia de insulina (72). Se observó que los compuestos
pertenecientes a una nueva clase de agentes sensibilizantes a la insulina,
denominados
Tiazoldinedionas, son un ligando específico para PPARy y estimulan la acción de
la
insulina. En ensayos clinicos recientes la trogliotazona, un miembro de la
familia de las
Tiazoldinedionas mejoró estados de resistencia a la insulina en pacientes con
diabetes
mellitus no insulinodependiente y SOP (73).
LIPOLISIS: DESREGULACIÓN ADRENÉRGICA
El desequilibrio entre la captación y la degradación de triglicéridos en los
adipocitos
abdominales conduce a la acumulación de grasa y al desarrollo de obesidad en la
parte
superior del cuerpo. En el tejido adiposo humano, las catecolaminas estimulan
la
lipólisis a través de adrenorreceptores beta 1 y beta 2, e inhiben la lipólisis
a través de
adrenorreceptores alfa 2. En época reciente se identificó un tercer
adrenorreceptor beta
(adrenorreceptor beta 3), específico para los adipocitos humanos, sobre todo en
el
depósito adiposo epiploico (74). Las mujeres no obesas con SOP presentan una
alteración pronunciada de la lipólisis inducida por catecolaminas debido a una
disminucion de la densidad de los adrenoreceptores beta 2 y a una menor
actividad de la
proteína cinasa complejo lipasa hormonosensible (13). Estos defectos
lipolíticos son
similares a los hallados en mujeres con obesidad en la parte superior del
cuerpo y rasgos
del síndrome de resistencia a la insulina y podrían representar un mecanismo
primario
para el desarrollo de este síndrome. Como consecuencia de la resistencia a las
catecolaminas, un aumento compensador de la actividad simpática podría inducir
resistencia a la insulina e hiperinsulinemia, con hiperandrogenemia secundaria
resultante. Además, el defecto lipolítico primario favorece el desarrollo de
obesidad.
La disfunción adrenérgica en los adipocitos podría remontarse a una edad
temprana, dado que niñas adolescentes con SOP presentan defectos
endocrinometabólicos similares a los de las mujeres adultas con SOP (21).
ALTERACIONES DEL PERFIL DE LAS LIPOPROTEÍNAS
La alteración de los efectos de la insulina secundaria a una resistencia
periférica a la
insulina determina anormalidades del metabolismo de la glucosa y defectos de la
activación de actividades antilipolíticas en las pacientes con SOP. Varios
estudios con
muestras relativamente grandes demostraron un perfil anormal de las
lipoproteínas en
mujeres con SOP y resistencia a la insulina (75). Se observó que el perfil
lipídico de las
mujeres con SOP estaba relacionado en gran medida con el grado de resistencia a
la
insulina/hiperinsulinemia, independientemente de los niveles de andrógenos y el
IMC. .
Sin embargo, el nivel de ácidos grasos libres solo se encuentra elevado en las
pacientes
con SOP obesas y se correlaciona con los niveles de adipocidad y andrógenos en
comparación con una población control apareada por IMC, las alteraciones del
perfil
lipídico documentadas en mujeres con SOP fueron las siguientes:
Aumento de triglicéridos
Aumento del colesterol unido a lipoproteínas de baja densidad (LDL)
Disminución del colesterol unido a lipoproteínas de alta densidad (HDL)
Aumento del colesterol unido a lipoproteínas de muy baja densidad (VLDL)
Aumento apolipoproteína A1,B
Aumento ácidos grasos libres
Estos hallazgos son similares a los observados en pacientes con síndrome de
resistencia
a la insulina y aumento del riesgo cardiovascular. Además se documentó un nivel
elevado de inhibidor del activador del plasminógeno, fenómeno que junto con las
alteraciones de los lípidos es responsable de la incidencia aumentada de
hipertensión,
enfermedad cardíaca coronaria y trombosis en las mujeres con SOP ( 75).
RIESGO DE ENFERMEDAD A LARGO PLAZO
El entorno hormonal anormal característico del SOP puede predisponer a varias
condiciones vinculadas a la resistencia a la insulina, hiperandrogenismo o
ambas. Las
condiciones que han sido vinculadas al SOP incluyen Diabetes Mellitus tipo 2,
hipertensión, dislipidemia, enfermedad cardiovascular, diabetes gestacional e
hipertensión gestacional y algunas enfermedades malignas como CA de Endometrio,
de
mama y de ovario. ( 6)
RIESGO DE ENFERMEDADES A LARGO PLAZO EN SOP (INDEPENDIENTE DE LA OBESIDAD)
Riesgo incrementado definido o muy probable
Diabetes Mellitus Tipo 2
Dislipidemia
Cáncer Endometrial
Riesgo incrementado posible
Hipertensión
Enfermedad cardiovascular
Diabetes Gestacional
Hipertensión Gestacional
Cáncer de Ovario
Riesgo incrementado improbable Cáncer de Mama
Basado en perfiles de riesgo, las mujeres con SOP sería esperado un incremento
significativo del riesgo para enfermedad coronaria. De hecho, Dahlgren y col
(76)
encontró un riesgo relativo incrementado de 7 veces para infarto de miocardio
en SOP
en un modelo predictivo usando datos sobre factores de riesgo para enfermedad
coronaria entre su cohorte de mujeres con SOP y controles de la misma edad.
Pequeños estudios han reportado una alta prevalencia de ateroesclerosis en
cateterización cardiaca entre mujeres hirsutas (77) y mayor grosor de la intima
media en
ultrasonido carotideo entre mujeres con oligomenorrea y exceso de andrógenos
consistentes con SOP ; sin embargo, estos estudios no fueron impulsados para
evaluar el
riesgo relativo de enfermedad coronaria o enfermedad cerebrovascular en esta
situación.
Un estudio de 143 mujeres con una edad de 60 años o menor y que sufrieron
cateterización coronaria revelaron ovario poliquístico en 42% lo cual fue
asociado con
hiperandrogenismo, dislipidemia e incremento de los niveles de peptido C. En
este
estudio, las mujeres con ovario poliquistico tenían significativamente más
ateroesclerosis coronaria extensa medida por el número de segmentos coronarios
involucrados con más del 50% de estenosis (78).
Pierpont y col (79) ha publicado el único estudio a la fecha investigando
específicamente la mortalidad cardiovascular en SOP en un seguimiento a largo
plazo.
Se incluyeron 786 mujeres con una historia de SOP seguimiento por 42 años, de
estas
mujeres se registraron 59 muertes. El ratio de muertes esperadas a las
observadas como
resultado de toda la enfermedad circulatoria no fue incrementado en todas estas
mujeres
( la proporción estandarizada de mortalidad, 0.83; 95% CI, 0.46 a 1.37). la
proporción
estandarizada de mortalidad para enfermedad cardiaca isquémica fue 1.4 ( 95%
CI, 0.75
a 2.40).
CONSECUENCIAS CARDIOVASCULARES DEL SÍNDROME DE OVARIO
POLIQUISTICO
La enfermedad arterial coronaria macrovascular es un mayor riesgo en SOP. Se
incrementa unas cuatro veces el riesgo relativo de infarto de miocardio en
mujeres
posmenopáusicas con una historia de resección amplia de ovario por SOP en una
edad
de 40 a 49 años y unas 11 veces el incremento a la edad de 50 a 60 años fue
encontrado
en un estudio retrospectivo. El incremento del riesgo puede ser atribuible, en
parte, a la
resistencia a la insulina por muchos años con o sin subsecuente manifestación
de
diabetes tipo 2, obesidad, hiperlipidemia, hipertensión, hiperandrogenismo y
disminución de la fibrinolisis.
HIPERTENSIÓN
La hipertensión ocurre a menudo en pacientes obesas con SOP, en parte, debido a
la
resistencia a la insulina y secundariamente a la hiperinsulinemia que realza la
actividad
simpática. Incrementando el gasto cardiaco, vasoconstricción e incremento de la
reabsorción de sodio por el riñon son mecanismos que contribuyen al desarrollo
de
hipertensión. (80). Otros mecanismos potenciales incluyen el incremento de las
catecolaminas adrenales y liberación de glucocorticoides. El incremento de los
niveles
de testosterona en el SOP puede exacerbar la resistencia a la insulina y la
hipertensión
Resultados de varios estudios evaluando la hipertensión en pacientes con SOP
indican
que la presión sanguínea esta generalmente dentro del rango normal en mujeres
jóvenes.
(81) con la edad avanzada, la presión arterial sistólica tiende a incrementarse.
Asi, con
una medición de 24 horas de la presión sistólica arterial es más alto en
mujeres con SOP
cuando son comparadas con controles de la misma edad. Tarde en la vida, la
hipertensión sostenida es tres veces más posible en mujeres con SOP . Un
tratamiento
temprano, sostenido y agresivo de la obesidad, la hiperinsulinemia y la
hiperandrogenemia puede disminuir el desarrollo de hipertensión tarde en la
vida tanto
como el riesgo cardiovascular.
LÍPIDOS Y METABOLISMO LIPIDICO
Obesidad, resistencia a la insulina e hiperandrogenemia tipica del SOP están
asociadas
con hiperlipidemia, especialmente incremento de VLDL y LDL,
hipertrigliceridemia y
disminución de colesterol HDL. Deterioro de la antilipólisis dependiente de
insulina y
alteración de la actividad de la lipoproteinlipasa a la par con la lipasa
hepática con
disminución de la proteina transportadora del colesterol como acontece en la
hiperlipidemia ( 82).
La obesidad androide esta asociada con disminución del colesterol HDL2,
incremento
de triglicéridos, resistencia a la insulina e incremento del colesterol LDL, en
parte, las
concentraciones elevadas de acidos grasos y carbohidratos reflejan que no
pueden ser metabolizadas adecuadamente.
EL RIESGO DE DIABETES MELLITUS TIPO 2 EN MUJERES CON SOP
Entre los riesgos a largo plazo uno de los más importantes es el riesgo
incrementado de
Diabetes Mellitus tipo 2 ( DM 2 ). Achard and Thiers reconocieron primero la
asociación entre el SOP y DM 2 en 1921 en su descripción de una mujer barbuda
con
DM 2. más recientemente, un número de otros investigadores han confirmado este
riesgo.
Primero, Dunaif et al (83) reportaron un alto nivel de glucosa entre mujeres
con SOP
comparado con mujeres normales y una mayor frecuencia de intolerancia a la
glucosa
entre mujeres con SOP. Más tarde un estudio retrospectivo de mujeres
posmenopáusicas con una historia de SOP demostró que 15% tenía DM 2, comparado
con un 2.3% de prevalencia entre controles de la misma edad .
Legro et al ( 84 )en un estudio prospectivo de una población de 254 pacientes
blancas
no hispánicas con SOP reclutadas en dos instituciones en los EEUU. Todos los
sujetos
sufrieron un test de tolerancia a la glucosa de dos horas y fluctuaron en una
edad de 14-
44 años con un 70% de prevalencia de obesidad. Usando los criterios de la
Organización Mundial de la Salud de 1985, 31.1% de estos pacientes demostraron
intolerancia a la glucosa y 7.5% tenían una franca DM 2. entre la edad de las
mujeres
de 25-35 años, 10% fueron afectadas de DM 2, mientras 21% de las mujeres con
SOP
de 35-40 años fueron afectadas. Este estudio incluye pocas mujeres sobre los 40
años.
Significativamente, 3.2% habría sido clasificado a tener DM 2 usando los
criterios de
ADA 1997, mientras el 7.5% podría ser clasificado de estar afectado usando los
criterios diagnósticos de la WHO.
Globalmente , pacientes con SOP, sin tener en cuenta la etnicidad, parecen
tener de 5 a
10 veces mayor riesgo de DM 2 , comparado con mujeres de la misma edad y peso.
TRATAMIENTO
Las mujeres con SOP generalmente reciben cuidados de salud a traves de
cosmetólogos,
médicos generales y ginecólogos endocrinólogos debido a los problemas asociados
con
hiperandrogenismo, obesidad, irregularidades menstruales o infertilidad.
Infortunadamente, la hiperinsulinemia y sus efectos deletereos a largo plazo,
incluyendo
la potenciación de la evolución de enfermedad macrovascular, son menospreciados
por
los médicos y pacientes. El resultado es una falta de implementación agresiva
de
medidas que puedan retardar la evolución de la enfermedad macrovascular y que
pueda
ofrecer protección contra eventos coronarios a la edad de los 40s o más. Lo
esencial del
tratamiento es semejante a la necesidad de corregir la hipertensión en
pacientes
asintomáticos en una gran población. En mujeres con SOP, el diseño de un
tratamiento
vigoroso para aminorar la hipertensión, normalización del metabolismo , reducir
la
hiperinsulinemia y favorecer la normalización de la esteroidogenesis es
necesario si una
protección óptima contra la enfermedad macrovascular y su consecuente
morbimortalidad quiere ser alcanzada. Así, las mujeres con SOP deberían ser
evaluadaqs con respecto a la presencia o ausencia de hiperlipidemia,
intolerancia a los
carbohidratos, resistencia a la insulina, hipertensión y manifestaciones de
enfermedad
macrovascular oculta. La presencia de cualquiera de estos fenómenos o
manifestaciones deberóia llevar al apropiado mantenimiento profiláctico sobre
muchos
años con monitoria apropiada.
RECOMENDACIONES (33)
De nivel A:
Todas las mujeres con SOP debería ser evaluada para intolerancia a la glucosa
con
niveles de glucosa a las dos horas después de una carga de glucosa en ayunas de
75
gramos.
Todas las mujeres con SOP deberían ser evaluadas para dislipidemia con un
perfil de
lipoproteínas en ayunas, incluyendo colesterol total, LDL,HDL, y determinación
de
triglicéridos.
Intervenciones que mejoren la sensibilidad a la insulina, incluyendo perdida de
peso,
uso de metformina y uso de troglitazonas, son útiles en mejorar la frecuencia
ovulatoria
en mujeres con SOP.
el uso de citrato de clomifeno es apropiado debido a su efectividad en
resultados en
embarazo en mujeres con SOP.
De nivel B:
La mejoría en la sensibilidad a la insulina, por perdida de peso o por el uso
de agentes
sensibilizantes, puede mejorar favorablemente muchos factores de riesgo para
diabetes
y enfermedad cardiovascular en mujeres con SOP.
Cuando se usen gonadotropinas para inducir ovulación, la terapia de baja dosis
es
recomendada debido a que esto ofrece una alta proporción de dasarrollo
monofolicular y
un riesgo significativamente bajo de hiperestimulación ovárica en mujeres con
SOP.
MANEJO HOMOTOXICOLOGICO:
1. DETOXIFICACION GENERAL:
NUX VOMICA HOMACCORD:
PULSATILLA COMPOSITUM:
LYMPHOMYOSOT N:
BERBERIS HOMACCORD:
2. DISMINUCIÓN DE PESO:
GRAPHITES HOMACCORD:
STRUMEEL:
NUX VOMICA HOMACCORD
3. ESTABILIZACIÓN HORMONAL
:
HORMEEL
4. PRODUCCIÓN DE OVULACIÓN:
OVARIUM COMPOSITUM
HOMOTOXICOLOGIA:
El origen de esta terapia aparece con el Dr. Hans-Heinrich Reckeweg, quien
estableció
las bases de la Homotoxicología uniendo el principio de similitud de Hahnemann
y el
principio de ArndtSchulz (22, 23, 24) con los avances de la medicina
contemporánea.
Las distintas opciones que nos ofrece esta terapia se basan en las distintas
posibilidades
de los medicamentos que presenta, como son (22, 24):
Medicamentos homeopáticos compuestos. x
Medicamentos homeopáticos unitarios. x
Catalizadores intermediarios. x
Organopreparados-“suis”. x
Nosodes. x
No sólo contamos con una amplia gama de medicamentos, sino que también contamos
con distintas opciones en cuanto a la vía de administración.
De esta forma, podremos individualizar el tratamiento. A pesar de que el
tratamiento
debe ser lo más individualizado posible, es posible presentar ciertas
orientaciones
generales o protocolos básicos basados en trabajos anteriores (25,26, 27).
1. Protocolos terapéuticos en la mujer:
Primera opción: Hormeel (10 gotas veces al día) y Mulimen (15 gotas 2veces al x
día) más Ovarium suis Injeel (la 1ª y 2ª semana después de la regla días
alternos) (la 3ª y 4ª semana después de la regla).
Segunda opción: Hormeel (10 gotas3 veces al día) y Mulimen (15 gotas 2veces x
al día) más Ovarium compositum vía subcutánea (las dos primeras semanas
después de la regla, 1-2 veces cada semana).
Medicamentos complementarios: Ignatia-Homaccord, Galium-Heel, Pulsatilla x
Injeel.
2. Complementos para los protocolos en la pareja:
Catalizadores: Coenzyme compositum,Ubichinon compositum.• x
Oligoelementos: Zn-Ni-Co a días alternos.
